- portada
- temas comerciales
- cooperaci髇 t閏nica
- propiedad intelectual
INFORMACION SOBRE LA PROPIEDAD INTELECTUAL: OMS-OMPI-OMC
Cap韙ulo 4: Tecnolog韆s m閐icas: la dimensi髇 relativa al acceso
B. Los determinantes del acceso relacionados con los sistemas de salud
Puntos destacados |
|
|
|
|
|
|
|
|
|
|
|
|
Hay distintos determinantes del acceso a los medicamentos u otras tecnolog韆s m閐icas y la falta de acceso pocas veces se debe 鷑icamente a uno solo. En las secciones siguientes se examinan los principales determinantes del acceso vinculados a la salud, la propiedad intelectual y el comercio.
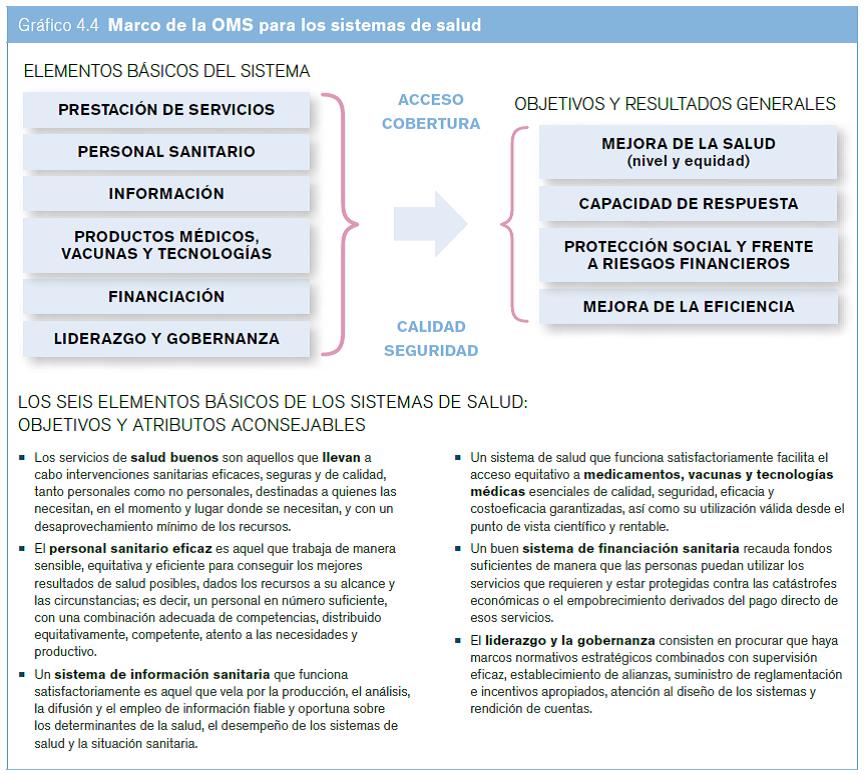
Un determinante general del acceso a las tecnolog韆s m閐icas es un sistema de salud que funcione correctamente. Los sistemas de salud se componen de todas las organizaciones, personas y medidas cuya finalidad principal es promover, restablecer o mantener la salud (OMS, 2000a). La OMS conceptualiza los sistemas de salud en funci髇 de seis elementos b醩icos cuya interacci髇 ayuda a lograr los resultados sanitarios deseados mediante la cobertura universal y el acceso equitativo a atenci髇 sanitaria segura y de calidad garantizada (v閍se el gr醘ico 4.4).
Un elemento b醩ico importante de todo sistema de salud es el acceso equitativo a productos m閐icos esenciales de calidad, seguridad, eficacia y costoeficacia garantizadas, as?como su utilizaci髇 v醠ida desde el punto de vista cient韋ico y rentable (OMS, 2007). Los seis elementos b醩icos de los sistemas de salud son interdependientes (v閍se el gr醘ico 4.4).
En la presente secci髇 se describen algunos de los principales determinantes del acceso a los medicamentos y a las tecnolog韆s m閐icas relacionados con los sistemas de salud. Se explica la importancia de las medidas de control de precios de los medicamentos en la determinaci髇 del acceso y se expone c髆o los impuestos, derechos y m醨genes de utilidad elevados pueden hacer que los medicamentos se tornen inasequibles cuando se imponen a los precios de los fabricantes. Los mecanismos eficaces de compras del sector p鷅lico tambi閚 pueden facilitar el acceso, al igual que lo pueden hacer, en determinadas condiciones, la producci髇 local y la transferencia de tecnolog韆 correspondiente. En la 鷏tima parte de esta secci髇 se examina la reglamentaci髇 de los medicamentos y las tecnolog韆s m閐icas, y se explica por qu?son aspectos importantes para facilitar el acceso a productos de calidad.
Fuente: OMS (2007).
1. Pol韙icas, controles de precios y fijaci髇 de precios de referencia de los medicamentos gen閞icos
Las pol韙icas orientadas a aumentar la cuota de mercado de los medicamentos gen閞icos m醩 baratos, controlar los precios de esos medicamentos y reglamentar la cuant韆 de los reembolsos de gastos m閐icos son intervenciones fundamentales para controlar los presupuestos de salud y hacer m醩 asequibles los medicamentos y otros productos sanitarios.
(a) Pol韙icas de medicamentos gen閞icos
El uso de medicamentos gen閞icos ha venido aumentando de forma constante no solo en los pa韘es en desarrollo sino tambi閚 en los desarrollados como consecuencia de la presi髇 econ髆ica sobre los presupuestos de salud. Muchos pa韘es est醤 aplicando distintas medidas para aumentar la cuota de mercado de los medicamentos gen閞icos m醩 baratos a fin de controlar los presupuestos de salud. Las patentes de muchos f醨macos actuales muy vendidos est醤 por expirar y en los pr髕imos a駉s se prev?que la cuota de mercado de los medicamentos gen閞icos aumente todav韆 m醩.
Las pol韙icas de medicamentos gen閞icos pueden dividirse seg鷑 act鷈n sobre la oferta o la demanda (King y Kanavos, 2002).
(i) Medidas que act鷄n sobre la oferta
Estas medidas van dirigidas principalmente a las partes interesadas del sistema de atenci髇 sanitaria que son responsables de la reglamentaci髇, el registro, la pol韙ica de competencia (antimonopolio), los derechos de propiedad intelectual, la fijaci髇 de precios y los reembolsos de los medicamentos. Con estas medidas los responsables de la formulaci髇 de pol韙icas pueden influir en:
- la rapidez con que el organismo de reglamentaci髇 examina un producto gen閞ico;
- la decisi髇 de cu醤do conceder una patente mediante la aplicaci髇 de una definici髇 adecuada de los criterios de patentabilidad;
- la relaci髇 entre la autorizaci髇 de venta de los medicamentos y su protecci髇 con patentes (excepci髇 Bolar y vinculaci髇 de las patentes);
- la forma en que los datos de ensayos cl韓icos se protegen de la competencia desleal;
- la habilidad de los fabricantes de medicamentos originarios para ampliar la protecci髇 de la propiedad intelectual, por ejemplo, mediante la ampliaci髇 del per韔do de vigencia de las patentes;
- el grado de competencia entre los fabricantes, y el seguimiento de los acuerdos entre las empresas de originarios y las de gen閞icos;
- los precios de los productos gen閞icos; y
- el reembolso a los compradores de medicamentos.
(ii) Medidas que act鷄n sobre la demanda
Generalmente, estas medidas van dirigidas a los interesados directos como los profesionales sanitarios que recetan medicamentos (normalmente m閐icos), las personas que los dispensan o venden y los pacientes o consumidores que solicitan medicamentos gen閞icos. Estas medidas suelen relacionarse con actividades que tienen lugar despu閟 de que una empresa de originarios ha perdido la exclusividad comercial y los medicamentos gen閞icos han entrado en el mercado.
Mediante la aplicaci髇 de medidas adecuadas que act鷄n sobre la demanda, los responsables de la formulaci髇 de pol韙icas pueden influir en:
- la receta por los m閐icos de versiones gen閞icas de los medicamentos utilizando la DCI o el nombre gen閞ico, en lugar del nombre comercial;
- al despacho de las versiones gen閞icas por las personas que dispensan o venden medicamentos;
- la confianza de los prescriptores, dispensadores y consumidores en la calidad de los medicamentos gen閞icos;
- las caracter韘ticas del consumo general de los medicamentos gen閞icos en el sistema de atenci髇 sanitaria;
- la demanda del consumidor por productos gen閞icos mediante copagos m醩 elevados para los productos originarios; y
- la percepci髇 que se tiene de los medicamentos gen閞icos (a menudo los pacientes reconocen que los gen閞icos pueden ayudar a reducir los costos, pero muchos siguen prefiriendo los productos originarios).
En los pa韘es de ingresos altos, la mayor韆 de las pol韙icas funcionan mediante un sistema de seguro de salud que cuenta con modalidades de reembolso o exige copagos m醩 elevados para incentivar a los consumidores a optar por los medicamentos gen閞icos. Las diferencias entre los pa韘es de ingresos altos y los PBI y los PIM en cuanto a los factores contextuales que influyen en las pol韙icas a favor de los medicamentos gen閞icos dificultan prever qu?pol韙icas pueden trasladarse satisfactoriamente de los pa韘es de ingresos altos a los PBI y los PIM.
Pueden ser necesarias dos condiciones favorables para que los PBI y los PIM ejecuten con eficacia las pol韙icas a favor de los medicamentos gen閞icos:
- un mecanismo que ofrezca la certidumbre de que los medicamentos gen閞icos son de calidad garantizada, lo que supone disponer de un sistema de reglamentaci髇 eficaz y, posiblemente, de un sistema operativo de marcas de comercio; y
- un suministro regular de medicamentos gen閞icos para lograr el abasto de medicamentos de calidad garantizada y bajo costo.
Las caracter韘ticas de los sistemas de atenci髇 sanitaria en muchos PBI y PIM indican que las pol韙icas que act鷄n sobre la demanda impulsadas por los consumidores pueden ser m醩 importantes, ya que estos pagan de su bolsillo los medicamentos y eligen los productos que compran sin la mediaci髇 de los prescriptores.
(b) Control de precios
Hay posibilidades de que los fabricantes exploten la exclusividad comercial al hacer frente a la demanda de medicamentos que permanece relativamente constante, independientemente de los cambios de precio (la llamada "demanda inel醩tica"). Esto ha llevado a muchos pa韘es a regular los precios de al menos una parte del mercado farmac閡tico, con mayor frecuencia de los productos patentados. El Canad?y M閤ico, por ejemplo, han establecido la regulaci髇 de la revisi髇 de precios de los productos farmac閡ticos patentados, una medida encaminada a velar por que los precios pagados por cualquier sector de la poblaci髇, con o sin seguro de enfermedad, no sean excesivos. En la mayor韆 de los pa韘es de ingresos altos, los planes de seguro exigen que los fabricantes acepten l韒ites de precios a cambio de financiaci髇 mediante reembolso.1
Se han utilizado varias estrategias de control de precios, entre ellas, controlar las ganancias de los fabricantes, controles directos de los precios, comparar los precios con referencias internas o externas, limitar los gastos de los m閐icos, hacer cumplir las directrices en materia de prescripci髇, condicionar la autorizaci髇 de venta a los precios y poner l韒ites a la promoci髇 de los medicamentos. Las medidas de control de precios tambi閚 han sido objeto de disputas en las jurisdicciones nacionales.
Los controles de precios pueden aplicarse en los niveles de fabricante, mayorista o minorista (en el recuadro 4.4 se indican los precios de referencia y los controles de precios en Colombia). El m閠odo m醩 directo consiste en que los gobiernos establecen el precio de venta y evitan las ventas a otros precios. Los gobiernos que gozan de determinado poder monopson韘tico (donde hay un solo comprador) tambi閚 pueden negociar precios favorables directamente con los fabricantes. El primer m閠odo puede basarse en c醠culos de los costos que pudieran ser inexactos, en tanto que el segundo puede ser m醩 satisfactorio, dependiendo del grado de poder monopson韘tico de que goce el gobierno. El Consejo Examinador de Precios de Medicamentos Patentados del Canad?protege los intereses de los consumidores al velar por que los precios de los medicamentos patentados no sean excesivos; examina los precios que los titulares de las patentes cobran por los productos patentados en los mercados canadienses y, si considera que un precio es excesivo, puede ordenar reducciones de los precios o la compensaci髇 de los ingresos en exceso (v閍se www.pmprb-cepmb.gc.ca/).
Otro m閠odo utilizado por los gobiernos consiste en establecer un precio de reembolso artificialmente bajo para un medicamento nuevo, de modo que todo precio superior deba ser pagado por el paciente. El precio de reembolso funciona entonces como el precio real de mercado. Por 鷏timo, los gobiernos pueden reducir peri骴icamente el precio de reembolso de los medicamentos comercializados; estos tipos de controles son intervenciones en el mercado, y los precios controlados deben generar beneficios razonables para evitar que los proveedores necesarios se vean obligados a salir del mercado.
Recuadro 4.4. Precios de referencia y controles de precios en Colombia |
La Comisi髇 Nacional de Precios de Medicamentos fija los precios de referencia de todos los medicamentos comercializados en el sector p鷅lico del pa韘 al menos una vez por a駉. Para ello, tiene en cuenta el precio promedio en el mercado nacional de un grupo de productos farmac閡ticos homog閚eos, es decir, productos de composici髇, dosis y f髍mula id閚ticas. Si el precio aplicado a esos medicamentos es superior al precio de referencia de los productos homog閚eos, se aplican controles directos de precios y la Comisi髇 fija un precio m醲imo al consumidor. |
Tambi閚 se aplican controles directos de precios si hay menos de tres productos homog閚eos en el mercado. En tales casos, la Comisi髇 establece un precio internacional de referencia mediante la comparaci髇 del precio aplicado al mismo producto en al menos tres de ocho pa韘es escogidos de la regi髇 (la Argentina, el Brasil, Chile, el Ecuador, M閤ico, Panam? el Per?y el Uruguay) y en los pa韘es de la OCDE. El precio menor que se encuentre en estos pa韘es se fija como el precio m醲imo al consumidor en Colombia. |
Tambi閚 se aplican controles directos de precios si hay menos de tres productos homog閚eos en el mercado. En tales casos, la Comisi髇 establece un precio internacional de referencia mediante la comparaci髇 del precio aplicado al mismo producto en al menos tres de ocho pa韘es escogidos de la regi髇 (la Argentina, el Brasil, Chile, el Ecuador, M閤ico, Panam? el Per?y el Uruguay) y en los pa韘es de la OCDE. El precio menor que se encuentre en estos pa韘es se fija como el precio m醲imo al consumidor en Colombia. |
La aplicaci髇 de controles de precios ha tenido una funci髇 destacada en el caso de la combinaci髇 de lopinavir y ritonavir suministrada a los pacientes infectados por el VIH o aquejados de sida en Colombia. En 2009, el Ministerio de Salud rechaz?una solicitud de licencia obligatoria de 2008 aduciendo falta de inter閟 p鷅lico. Dado que esta combinaci髇 medicamentosa figuraba en la lista nacional de medicamentos esenciales, las aseguradoras estaban obligadas a suministrarla y por lo tanto el precio aplicado por el titular del derecho no obstaculizar韆 el acceso. Al mismo tiempo, la Comisi髇 decidi?regular el precio de la combinaci髇; los precios se fijaron en 1.067 d髄ares EE.UU. para el sector p鷅lico y en 1.591 d髄ares EE.UU. para el sector privado, lo que represent?una reducci髇 promedio de entre el 54 y el 68% por persona al a駉 (Asociaci髇 Brasile馻 Interdisciplinaria de Sida, 2009). La apelaci髇 del titular del derecho contra la decisi髇 fue rechazada, y en 2010 la empresa originaria acord?vender la combinaci髇 medicamentosa al precio fijado por la Comisi髇.
(c) Fijaci髇 de precios de referencia
Este mecanismo puede determinar o utilizarse para la negociaci髇 del precio regulado a escala nacional o el nivel de reembolso de un producto sobre la base del precio o los precios de un producto farmac閡tico en otros pa韘es (externa) o en relaci髇 con los tratamientos existentes en el mismo pa韘 (interna). De ordinario, se controla as?el nivel de reembolso y por lo tanto es 鷗il principalmente en los pa韘es con sistemas basados en seguros; se considera menos restrictivo que los controles directos de precios.
(i) Fijaci髇 de precios de referencia externa
Es la pr醕tica de comparar el precio o los precios de un producto farmac閡tico con los precios que tiene en un conjunto de pa韘es de referencia (Espin et al., 2011). Pueden emplearse diversos m閠odos para escoger los pa韘es de referencia de una "canasta" y para calcular los precios de referencia externa; tambi閚 hay muchas maneras de llevar esto a la pr醕tica. En el recuadro 4.4 se describe c髆o funcionan la fijaci髇 de precios de referencia externa y los controles de precios en Colombia.
(ii) Fijaci髇 de precios de referencia interna
Por el contrario, en este m閠odo se comparan medicamentos iguales o similares en el mismo pa韘. Los productos que se comparan est醤 clasificados seg鷑 el sistema de Clasificaci髇 Anat髆ica, Terap閡tica y Qu韒ica, que separa los medicamentos con arreglo a cinco niveles, que abarcan desde el 髍gano o sistema en que act鷄n hasta su estructura qu韒ica (5.o nivel).
(d) Evaluaciones de las tecnolog韆s sanitarias
En los 鷏timos a駉s, un n鷐ero cada vez mayor de pa韘es han comenzado a introducir planes de remuneraci髇 con arreglo al desempe駉 basados en estas evaluaciones, las cuales permiten determinar los beneficios m閐icos y la costoeficacia de un tratamiento dado como medio para contener los costos y dirigir los gastos a mejorar la salud (Kanavos et al., 2010).
Dicha evaluaci髇 es un proceso multidisciplinario: se recaba informaci髇 de manera sistem醫ica, transparente e imparcial acerca de las cuestiones m閐icas, sociales, econ髆icas y 閠icas relacionadas con el uso de una tecnolog韆 sanitaria, a fin de fundamentar la formulaci髇 de pol韙icas sanitarias seguras, eficaces, centradas en los pacientes y orientadas a alcanzar una relaci髇 髉tima entre el precio y la calidad.4 Por consiguiente, esta evaluaci髇 aplicada a los medicamentos, los dispositivos m閐icos o las intervenciones cl韓icas o quir鷕gicas no solo examina su seguridad, eficacia o eficiencia, sino tambi閚 analiza los costos y beneficios, y eval鷄 otros aspectos de la utilizaci髇 de un producto m閐ico o tecnolog韆. Aunque estas evaluaciones pueden diferir ampliamente, los an醠isis de los costos y beneficios se centran en la eficacia cl韓ica (comparaci髇 de los resultados sanitarios de otras tecnolog韆s con las opciones disponibles) y en la costoeficacia (comparaci髇 de las mejoras de los resultados sanitarios con los costos adicionales que supone la tecnolog韆). Esta 鷏tima comparaci髇 permite determinar si los costos son proporcionales a los resultados sanitarios y, por lo tanto, si el producto m閐ico debe suministrarse al paciente (para obtener mayor informaci髇, v閍se Garrido et al., 2008). A鷑 no es posible determinar en qu?medida las evaluaciones de las tecnolog韆s sanitarias contribuir醤 a controlar los gastos sanitarios a largo plazo.
(e) Limitaciones al volumen
Los gobiernos tambi閚 pueden imponer limitaciones al volumen para controlar la cantidad que puede venderse de un medicamento nuevo. Francia impone a los fabricantes de medicamentos nuevos acuerdos sobre el precio y el volumen (OECD, 2008). En este esquema el precio de reembolso de un medicamento nuevo se vincula con el umbral del volumen de ventas; si se supera el valor umbral, el fabricante debe ofrecer una compensaci髇 mediante la reducci髇 del precio o pagos en efectivo al gobierno (seg鷑 el pa韘), o bien, la retirada del producto del mercado. Con estas limitaciones al volumen el pagador puede controlar las repercusiones m醲imas en los costos que supone la introducci髇 de los tratamientos nuevos y caros, y limitar el incentivo a las empresas para promover su utilizaci髇 amplia.
2. Estrategias de fijaci髇 de precios diferenciales
Esta pr醕tica se conoce tambi閚 como fijaci髇 escalonada de precios o discriminaci髇 de precios. Tiene lugar cuando las empresas cobran precios distintos por el mismo producto en funci髇 de las distintas clases de compradores, sin que ello pueda explicarse por diferencias en los costos de producci髇. Puede haber precios diferenciales en las distintas zonas geogr醘icas o seg鷑 las diferencias en el poder de compra y los sectores socioecon髆icos. Dado que este m閠odo supone la divisi髇 de los mercados en distintos niveles o grupos, la pr醕tica tambi閚 se denomina fijaci髇 escalonada de precios. Esta discriminaci髇 de precios solo es factible en la medida en que los mercados puedan dividirse eficazmente, a fin de evitar el arbitraje (la compra de productos en el mercado donde el precio es menor para su venta posterior en el mercado donde el precio es m醩 elevado).
La fijaci髇 escalonada de precios puede llevarse a cabo de distintas maneras. Las empresas privadas pueden negociar acuerdos individuales con otras empresas; tambi閚 pueden negociar descuentos de precios con los gobiernos o mediante acuerdos regionales o mundiales de compras al por mayor y licencias de producci髇 para determinados mercados. La segmentaci髇 del mercado puede lograrse mediante varias estrategias de comercializaci髇 (por ejemplo, utilizando diferentes marcas de comercio, acuerdos de licencias, formas farmac閡ticas o presentaci髇 de los productos), un control m醩 estricto de la cadena de suministro por parte de los compradores y controles a la importaci髇 en los pa韘es de ingresos altos y a la exportaci髇 en los pa韘es m醩 pobres (en el recuadro 4.5 se presenta el envasado diferenciado como otro modo de apoyar las estrategias de fijaci髇 de precios diferenciales). En principio, la fijaci髇 de precios diferenciales puede hacer que los medicamentos sean m醩 asequibles para sectores m醩 amplios de la poblaci髇 y tambi閚 puede dar lugar a un aumento de las ventas, lo que supone un beneficio para los fabricantes de productos farmac閡ticos (Yadav, 2010).
No obstante, llega a su l韒ite cuando el grado de asequibilidad de los pacientes es menor que el costo marginal de fabricaci髇. As?pues, la fijaci髇 de precios diferenciales solo puede ser una pol韙ica complementaria, en tanto que el compromiso continuo del gobierno para proporcionar a los pobres acceso a los medicamentos es fundamental (Yadav, 2010).
Las empresas a veces son renuentes a seguir estrategias de fijaci髇 escalonada de precios, posiblemente debido al temor a la mengua de los precios en los mercados de ingresos altos como consecuencia del arbitraje. Asimismo, a veces son renuentes a ofrecer precios diferenciales a los pa韘es de ingresos medianos, ya que pueden tener dificultades para mantener precios m醩 elevados en los mercados vecinos o en los pa韘es con un nivel de ingreso similar.
La capacidad de establecer diferencias dentro de los pa韘es en funci髇 de los sectores socioecon髆icos de la poblaci髇 y entre los sectores p鷅lico y privado puede servir para superar estas dificultades. Evitar que los productos de menor precio regresen a los mercados privados de ingresos altos seguir?siendo un problema, pero es posible que la tendencia est?cambiando. En el recuadro 4.5 se presenta un ejemplo de c髆o puede utilizarse el envasado diferenciado para separar los mercados. 趌timamente, varias empresas dedicadas a la investigaci髇 han ejecutado programas experimentales para ampliar el envasado diferenciado a las econom韆s emergentes, incluida la fijaci髇 de precios diferenciales en cada pa韘. Tambi閚 han ampliado estos programas para que abarquen una gama m醩 extensa de medicamentos, entre ellos, los productos biol骻icos y los medicamentos contra el c醤cer.5 Lo anterior indica que las empresas est醤 trabajando para adaptar su actual modelo de precio mundial 鷑ico a la realidad socioecon髆ica de las econom韆s emergentes, fundamentando su modelo empresarial en una correspondencia distinta entre volumen y precio.
Recuadro 4.5. El envasado diferenciado |
En 2001, como parte de un memorando de entendimiento entre la OMS y Novartis para ofrecer el medicamento artemetero-lumefantrina a precio de costo para su utilizaci髇 en el sector p鷅lico de los pa韘es donde el paludismo es end閙ico, esta empresa elabor?un envasado para el medicamento destinado al sector p鷅lico que difer韆 del de los productos destinados al sector privado. La OMS colabor?con la empresa para elaborar cuatro envases diferentes para los planes de tratamiento (destinados a cuatro grupos de edad distintos) con ilustraciones de c髆o tomar el medicamento y concebidos para mejorar la observancia terap閡tica en los grupos de poblaci髇 analfabetos. En un principio, los envases se distribuyeron a los servicios de adquisici髇 de la OMS y posteriormente a los del UNICEF; poco a poco se enviaron a otros servicios que abastecen 鷑icamente al sector p鷅lico. La desviaci髇 de estos envases del sector p鷅lico al privado es insignificante. El logotipo distintivo de "hoja verde" que figura en los envases facilita el seguimiento y la vigilancia de la disponibilidad y las cuotas de mercado en el punto de venta. |
Un ejemplo de fijaci髇 de precios diferenciales es la Iniciativa para Acelerar el Acceso, una asociaci髇 establecida en mayo de 2000 entre cinco organismos del sistema de las Naciones Unidas (el ONUSIDA, el UNICEF, el UNFPA, el Banco Mundial y la OMS) y cinco empresas farmac閡ticas, cuyo objetivo era corregir la falta de medicamentos y atenci髇 asequibles para tratar la infecci髇 por el VIH/sida en algunos pa韘es en desarrollo (WHO/UNAIDS, 2002). Las empresas aceptaron donar medicamentos u ofrecer reducciones considerables de los costos.
La fijaci髇 de precios diferenciales est?bien establecida en el mercado de las vacunas. Se utiliza una estructura de fijaci髇 de precios en tres niveles para la mayor韆 de las vacunas que se venden tanto en los pa韘es en desarrollo como en los desarrollados. Las empresas cobran los precios m醩 elevados en los pa韘es de ingresos altos, precios bajos en los pa韘es considerados prioritarios por la Alianza GAVI y precios intermedios en los pa韘es de ingresos medianos. Las vacunas tambi閚 son el sector donde la fijaci髇 de precios diferenciales est? m醩 difundida en cada pa韘; por ejemplo, una empresa ofrece la vacuna contra la hepatitis B a dos precios diferentes en la India, cuyo sector p鷅lico solo paga aproximadamente la mitad del precio que paga el sector privado.
3. Los impuestos
Si bien los medicamentos suelen estar sujetos a impuestos indirectos, como el impuesto sobre las compras, el impuesto sobre las ventas o el IVA, las entidades que los producen y venden tambi閚 pueden estar sujetas a impuestos directos sobre los ingresos generados (por ejemplo, el impuesto sobre la renta de las sociedades). Los impuestos se suman al precio final pagado por el consumidor y, por lo tanto, son un factor que afecta el acceso a los medicamentos.
En 2010, el IVA a los medicamentos en los pa韘es de ingresos altos estaba entre 0 y 25%, y Australia, el Jap髇 y la Rep鷅lica de Corea ten韆n una pol韙ica de exenci髇 fiscal. Asimismo, pa韘es como Colombia, Etiop韆, el Estado de Kuwait, Malasia, Nicaragua, Om醤, el Pakist醤, Uganda y Ucrania notificaron la exenci髇 del IVA y del impuesto sobre las ventas para los medicamentos. En los PBI y los PIM que gravaban los medicamentos, el tipo impositivo fluctu?entre el 5 y casi el 34%. En algunos PBI y PIM la situaci髇 con respecto a los grav醡enes aplicados a los medicamentos es todav韆 m醩 compleja y variable, ya que a veces se aplican muchos impuestos federales y estatales. Adem醩, los medicamentos importados y los de fabricaci髇 local a veces se gravan de forma diferente. El estudio concluye que los impuestos internos como el IVA o el impuesto sobre las ventas suelen ser el tercer componente en importancia del precio final de un medicamento (Creese, 2011).
Los precios de los medicamentos pueden reducirse con determinadas medidas fiscales pr醕ticas (en el recuadro 4.6 se presenta la experiencia peruana con las medidas de exenci髇 fiscal); una de ellas consiste en eximir de impuestos los medicamentos que tienen una demanda relativamente inel醩tica (es decir, la gente los comprar?independientemente de su precio). Por ejemplo, Mongolia elimin?los impuestos sobre el omeprazol importado que se vend韆 en las farmacias privadas, una medida que dio lugar a una ca韉a de los precios de entre 5,91 y 4,85 d髄ares EE.UU. por un paquete de 30 c醦sulas, en tanto que Filipinas elimin?el IVA de 12%, lo que redujo el precio de un paquete de 10 comprimidos de cotrimoxazol (480 mg) de 14,90 a 13,30 pesos (Creese, 2011).
Otra medida que puede mejorar el acceso a los medicamentos son las modificaciones de los tipos impositivos. Deber韆 ser posible evaluar las consecuencias de introducir cambios definidos en los tipos impositivos que mejoren o reduzcan el acceso a los medicamentos, y luego proponer los cambios correspondientes en las pol韙icas fiscales. En 2004, el Kirguist醤 redujo el IVA y el impuesto regional sobre las ventas de medicamentos, y el Pakist醤, despu閟 de una impugnaci髇 fruct韋era a favor del consumidor, elimin?por completo este 鷏timo, que era del 15%. Aunque las modificaciones de los tipos impositivos no pueden efectuarse hasta que haya un cambio en los reg韒enes fiscales nacionales, las repercusiones de esta medida pueden ser considerables (Creese, 2011). La eliminaci髇 de los derechos de aduana, que se examina m醩 adelante en este cap韙ulo, es una medida similar que puede incidir directamente en los precios y el acceso. Con todo, en ambos casos es importante velar por que el ahorro generado por la reducci髇 de los impuestos o derechos de aduana se transfiera al consumidor, ya que este no es siempre el caso, como se observa en el ejemplo del Per?(v閍se el recuadro 4.6).
Recuadro 4.6. Medidas de exenci髇 fiscal en el Per?para los medicamentos contra el c醤cer y la diabetes |
En 2010 y 2011, el Per?llev?a cabo dos estudios sobre las repercusiones de las medidas de exenci髇 fiscal en el precio de determinados medicamentos contra estas enfermedades. En el 75% de los 40 medicamentos antidiab閠icos comercializados en el sector minorista examinados en los estudios, las empresas no transmitieron las posibles reducciones de precios resultantes de la introducci髇 de las medidas de exenci髇 fiscal. En el sector p鷅lico, los precios del 44% de los medicamentos examinados no reflejaron los posibles beneficios derivados de las medidas de exenci髇 fiscal, mientras que el 56% reflejaron parcialmente tales medidas en forma de precios reducidos. En el caso de los medicamentos sin competencia, los precios no variaron, o bien, estuvieron sujetos a fluctuaciones importantes (hasta del 248%), seg鷑 el volumen comprado. |
De los cinco anticancerosos examinados que se comercializaron en el sector minorista antes y despu閟 de la introducci髇 de las medidas de exenci髇 fiscal, los precios disminuyeron en dos casos, pero no cambiaron en el caso de otros tres precios al por menor (es decir, el beneficio de las medidas de exenci髇 fiscal no repercuti?en los consumidores). |
En el sector p鷅lico, se evaluaron los precios de ocho medicamentos antes y despu閟 de la introducci髇 de las medidas de exenci髇 fiscal. En el caso de cuatro medicamentos, las empresas no hab韆n transmitido la exenci髇 fiscal en forma de precios reducidos; en cambio, los precios de los otros cuatro medicamentos disminuyeron. Despu閟 de la aplicaci髇 de las medidas mencionadas, los precios de los seis medicamentos que no ten韆n competencia permanecieron estables. Los precios disminuyeron en el caso de los dos medicamentos para los cuales hab韆 otras opciones en el mercado; en uno de estos casos, la reducci髇 alcanz?el 38%.6 |
La reducci髇 o eliminaci髇 de los impuestos sobre los medicamentos tambi閚 puede unirse al aumento o la introducci髇 de impuestos a los productos nocivos para la salud p鷅lica (por ejemplo, el tabaco, el alcohol y los alimentos malsanos). Los defensores de esta estrategia suelen argumentar que los fondos recaudados de los impuestos a los h醔itos de consumo y comportamientos poco saludables pueden equilibrar f醕ilmente, o algunas veces superar, las p閞didas de ingresos debidas a la reducci髇 o eliminaci髇 de los impuestos sobre los medicamentos, lo que deja en una mejor situaci髇 tanto al gobierno como a los individuos (Creese, 2011). En su opini髇, esta estrategia ofrecer韆 la posibilidad de relacionar ganancias econ髆icas importantes con un mejor acceso a los medicamentos.
4. M醨genes comerciales
Los m醨genes comerciales representan los cargos y costos adicionales que los distintos interesados directos aplican a lo largo de la cadena de suministro y la distribuci髇 para recuperar los costos fijos y los gastos de distribuci髇, y obtener beneficios. En el caso de los medicamentos dichos m醨genes pueden ser agregados por fabricantes, mayoristas, minoristas, farmac閡ticos y otros muchos actores que desempe馻n una funci髇 en la cadena de suministro y distribuci髇 (Ball, 2011). Al igual que los impuestos, los m醨genes comerciales inciden en el precio de los medicamentos y por lo tanto repercuten directamente en el acceso.
Los m醨genes comerciales, incluidos aquellos que cobran los mayoristas y minoristas, son comunes en las cadenas de suministro y distribuci髇 de los medicamentos tanto del sector p鷅lico como del privado. Por ejemplo, un an醠isis secundario de los estudios realizados por la OMS y Health Action International en pa韘es en desarrollo indic?que los m醨genes de venta al por mayor fluctuaron del 2% en un pa韘 a un margen comercial combinado de los importadores, distribuidores y mayoristas del 380% en otro pa韘 (Cameron et al., 2009). Adem醩, otro an醠isis secundario de estos estudios revel?que hay una enorme variabilidad en el porcentaje acumulado de los m醨genes comerciales (es decir, todos los a馻didos desde el precio de venta del fabricante hasta el precio final que paga el paciente) entre los sectores p鷅lico y privado (Cameron et al., 2009). Los m醨genes comerciales tambi閚 pueden variar seg鷑 el tipo de medicamento (originarios frente a gen閞icos). Sin una regulaci髇 adecuada de los m醨genes comerciales, el precio al consumidor puede aumentar considerablemente y, por consiguiente, repercutir mucho en el acceso a los medicamentos.
En los pa韘es de ingresos altos, la regulaci髇 de dichos m醨genes normalmente forma parte de una estrategia integral de fijaci髇 de precios que tambi閚 aborda el reembolso del costo de los medicamentos (Ball, 2011). Hay pocos datos sobre la regulaci髇 de los m醨genes comerciales en los PBI y los PIM. Los datos de las encuestas de indicadores de productos farmac閡ticos de la OMS indican que alrededor del 60% de los pa韘es de bajos ingresos notifican que regulan los m醨genes de venta al por mayor o al por menor. En los pa韘es de ingresos medianos, la regulaci髇 en el sector p鷅lico es similar (Ball, 2011).
La regulaci髇 de los m醨genes comerciales puede repercutir favorablemente en el acceso a los medicamentos, pero tambi閚 puede tener algunos efectos adversos (Ball, 2011); dado que reduce los m醨genes de las empresas, estas pueden dejar de ofrecer algunos medicamentos u ofrecerlos en cantidades reducidas, lo que perjudica la disponibilidad de los productos y la competencia de precios.
5. Mecanismos de adquisici髇 eficaces y eficientes
La adquisici髇 eficaz de productos m閐icos exige la coordinaci髇 sistem醫ica de las operaciones comerciales, la tecnolog韆 de la informaci髇, la garant韆 de la calidad, la gesti髇 de la seguridad y los riesgos, y los sistemas jur韉icos. Adem醩, es importante contener los costos mediante el examen peri骴ico de los modelos y las estrategias de adquisici髇, la vigilancia de los precios y el mantenimiento de registros, a fin de tomar decisiones fundamentadas (Ombaka, 2009).
(a) Principios de la adquisici髇 eficaz
Los sistemas de adquisici髇 est醤 concebidos para obtener medicamentos y ciertos productos de buena calidad en el momento oportuno, en las cantidades necesarias y a costos favorables. La OMS ha formulado una serie de principios operativos de estos sistemas, cuyo objetivo es aumentar el acceso mediante precios menores y un suministro ininterrumpido (OMS, 2001c). Estos principios se enumeran a continuaci髇:
- Repartir las diversas funciones y responsabilidades relacionadas con las adquisiciones (selecci髇, cuantificaci髇, especificaci髇 de los productos, preselecci髇 de los proveedores y adjudicaci髇 de licitaciones) entre las varias partes y dotar a cada una de los conocimientos t閏nicos y recursos necesarios para que desempe馿n su funci髇.
- Velar por la transparencia de los procedimientos de adquisici髇 y licitaciones, atenerse a normas escritas en todo el proceso, y aplicar criterios expl韈itos para la adjudicaci髇 de los contratos.
- Establecer un sistema fiable de gesti髇 de la informaci髇 que permita planificar y vigilar regularmente las actividades de adquisici髇, lo que incluye una auditor韆 externa anual.
- Limitar las actividades de adquisici髇 del sector p鷅lico a una lista de medicamentos esenciales o al formulario nacional o local para lograr que se adquieran los productos necesarios.
- Designar los medicamentos por su DCI o nombre gen閞ico en los documentos de adquisici髇 y licitaci髇.
- Las cantidades que figuran en los pedidos deben basarse en el consumo pasado, siempre que se haya comprobado que esos datos son correctos. Los datos sobre el consumo deben actualizarse continuamente, a fin de tomar en cuenta los cambios en la morbilidad, y factores como las estaciones del a駉 y las modalidades de prescripci髇 de los medicamentos.
- Financiar las adquisiciones mediante mecanismos fiables como las cuentas descentralizadas o los fondos rotatorios para la compra de medicamentos; en cada caso, el mecanismo en s?mismo tambi閚 debe disponer de fondos suficientes.
- Comprar las mayores cantidades que sea apropiado, a fin de lograr econom韆s de escala.
- Conseguir precios favorables sin menoscabo de la calidad cuando se compra para el sector p鷅lico.
- Vigilar este proceso de adquisici髇 cuando los precios se negocian en el nivel central, pero cada establecimiento de salud de la periferia efect鷄 los pedidos por separado.
- La precalificaci髇 de los proveedores es fundamental, y deben considerarse criterios como la calidad del producto, la fiabilidad del servicio, los plazos de entrega y la sostenibilidad financiera.
- Procurar que los medicamentos adquiridos sean de calidad garantizada, conforme a las normas internacionales.
Las partes del Acuerdo sobre Contrataci髇 P鷅lica de la OMC tambi閚 est醤 obligadas a efectuar licitaciones competitivas, no discriminatorias y transparentes para una variedad de compras p鷅licas en el sector de la salud. En diversas fuentes puede obtenerse m醩 orientaci髇 sobre c髆o organizar adquisiciones eficientes de las tecnolog韆s m閐icas. El programa de la OMS de buena gobernanza de las pr醕ticas farmac閡ticas ofrece apoyo t閏nico para abordar las cuestiones poco 閠icas en el sector p鷅lico (OMS, 2010d). La OMS ha creado un sistema modelo de garant韆 de la calidad para los organismos de adquisici髇 (OMS, 2006a). El Banco Mundial ha preparado directrices que contienen documentos de licitaci髇 normalizados y una nota t閏nica para uso de los organismos de ejecuci髇 que efect鷄n compras para el sector sanitario mediante licitaciones p鷅licas internacionales.7 Con la finalidad de combatir la infecci髇 por el VIH/sida, estas directrices se han adaptado en una gu韆 aparte dirigida a las instancias decisorias.8
(b) Adquisici髇 e informaci髇 sobre patentes
Los sistemas de adquisici髇 deben concebirse para conseguir medicamentos selectos y otros productos m閐icos de buena calidad en el momento oportuno, en las cantidades necesarias y a costos ventajosos. Aunque generalmente el proveedor es responsable de velar por que todos los derechos sobre los productos, incluidos los de propiedad intelectual, est閚 amparados con arreglo a las condiciones de los documentos de licitaci髇 y los contratos de compra, los organismos de adquisici髇 tambi閚 tienen que considerar la situaci髇 de las patentes de los productos al inicio del proceso de adquisici髇. La verificaci髇 de la validez de las patentes, las negociaciones de precios o licencias con el titular de la patente y la posible utilizaci髇 de licencias obligatorias o uso por parte de los gobiernos respectivos lleva tiempo. Por consiguiente, si esta informaci髇 se recoge en una etapa tard韆 del proceso de adquisici髇, los retrasos pueden llevar al agotamiento de las existencias. El contenido y las fuentes de informaci髇 sobre las patentes se explican m醩 a fondo en el subapartado viii) del apartado b) de la secci髇 B.1 del cap韙ulo II. Este tema tambi閚 se trat?en el simposio t閏nico "Acceso a los medicamentos, informaci髇 contenida en las patentes y libertad de acci髇", organizado conjuntamente por la OMS, la OMPI y la OMC, y celebrado en febrero de 2011.9
(c) Adquisiciones en com鷑
Tambi閚 conocidas como "compras colectivas" o "compras a gran escala", son las efectuadas por una sola oficina de adquisiciones en nombre de un grupo de establecimientos, sistemas de salud o pa韘es (Management Sciences for Health, 2012); constituyen una estrategia para hacer m醩 asequibles los medicamentos y ayudar a resolver problemas como la calidad deficiente y otros obst醕ulos generalmente asociados a las cadenas de adquisici髇 y suministro de los medicamentos esenciales.
Las econom韆s de escala y las perspectivas a largo plazo en materia de suministro, que son frecuentes en la mayor韆 de los sistemas de adquisici髇 del sector p鷅lico, permiten a los proveedores disminuir sus precios. Las adquisiciones en com鷑 en el sector de la salud se efect鷄n de una u otra manera tanto en los pa韘es en desarrollo como en los desarrollados. El sector p鷅lico y el privado (por ejemplo, un grupo de hospitales privados que comparten un sistema conjunto de adquisici髇) utilizan esos mecanismos en varias escalas. En los pa韘es de ingresos altos, los grandes sistemas de seguros y de reembolso apoyan las adquisiciones en com鷑 de medicamentos y otras tecnolog韆s m閐icas. Actualmente, los PBI y los PIM adoptan cada vez m醩 este m閠odo. En la India y China, los programas actuales para ampliar la atenci髇 sanitaria a poblaciones tan grandes ilustran este fen髆eno. En las adquisiciones del sector p鷅lico, casi todos los pa韘es se benefician de las ventajas que ofrecen las compras en gran escala. Muchos pa韘es de bajos ingresos han establecido organismos centrales de adquisici髇 para administrar las necesidades conjuntas del sistema de atenci髇 sanitaria; mediante los grandes pedidos logran econom韆s de escala y pueden negociar mejores precios. Los sistemas de adquisici髇 en com鷑 que funcionan plenamente contribuyen a perfeccionar los sistemas de control de la calidad y fomentan el mejoramiento de la infraestructura de almacenamiento y distribuci髇 para dar cabida a grandes cantidades de medicamentos y otras tecnolog韆s sanitarias.
Gracias a los sistemas satisfactorios de adquisici髇 en com鷑 se han notificado reducciones considerables del precio unitario de los medicamentos; entre los ejemplos m醩 conocidos est醤 la Organizaci髇 de Estados del Caribe Oriental; el Fondo Rotatorio Regional para Suministros Estrat間icos de Salud P鷅lica de la Organizaci髇 Panamericana de la Salud (OPS); el Fondo Rotatorio del Programa Ampliado de Inmunizaci髇 para la Compra de Vacunas de la OPS; la Asociaci髇 Africana de Establecimientos M閐icos Centrales para los Medicamentos Gen閞icos Esenciales; y el Programa de Compras Colectivas del Consejo para la Cooperaci髇 en el Golfo. La Organizaci髇 de Estados del Caribe Oriental, un monopsonio autosuficiente del sector p鷅lico, ha notificado sistem醫icamente reducciones considerables del precio unitario de los medicamentos. Un estudio anual realizado de 2001 a 2002 con 20 medicamentos populares en esa regi髇 revel?que los precios del sistema de adquisiciones en com鷑 de dicha organizaci髇 eran 44% menores que los de cada pa韘 (OECS, 2001). El Programa de Compras Colectivas del Consejo para la Cooperaci髇 en el Golfo tambi閚 constat? que la mejora del proceso de adquisici髇 puede reducir los costos y aumentar la eficiencia de los servicios de salud. El Fondo Estrat間ico de la OPS, establecido por la secretar韆 de esa organizaci髇 a petici髇 de sus Estados miembros, es otro ejemplo de adquisiciones en com鷑. Actualmente, 23 Estados miembros de la OPS participan en ese fondo estrat間ico, creado para promover el acceso a suministros esenciales de salud p鷅lica de calidad en la Regi髇 de las Am閞icas. El Fondo Mundial emplea el mecanismo de adquisiciones en com鷑 voluntarias como una manera rentable de facilitar la compra eficiente de antirretrov韗icos, estuches de pruebas diagn髎ticas r醦idas para la infecci髇 por el VIH y el paludismo, tratamientos combinados a base de artemisinina y mosquiteros con insecticida de acci髇 prolongada (Global Fund, 2010a; 2010b).
6. Producci髇 local y transferencia de tecnolog韆
La mayor韆 de los pa韘es importan medicamentos, medios de diagn髎ticos vacunas y otros productos m閐icos del mercado mundial; aun as? varios PBI y PIM aspiran a crear y fortalecer sus industrias nacionales de productos m閐icos. Las tendencias indican que la producci髇 local est?aumentando y diversific醤dose en algunos de estos pa韘es10, pero no hay datos concluyentes de que ello se acompa馿 de un mayor acceso a esos productos (OMS, 2011g).
Para alcanzar la viabilidad econ髆ica, los productores locales, sobre todo en los pa韘es de bajos ingresos, tienen que afrontar una serie de dificultades, a saber:
- infraestructura material precaria;
- escasez de personal t閏nico debidamente capacitado;
- dependencia de materias primas importadas, en particular principios activos;
- mercados d閎iles e inciertos;
- falta de econom韆s de escala;
- derechos e impuestos de importaci髇 elevados;
- falta de un entorno normativo propicio y de coherencia de las pol韙icas en todos los sectores;
- medidas de control de calidad y reglamentaci髇 endebles;
- productos o tecnolog韆s fundamentales protegidos por patentes; y
- autorizaci髇 reglamentaria ulterior debido a normas relativas a la exclusividad de los datos, en donde se reconocen.
Superar estas dificultades puede aumentar el costo de producci髇, con lo cual el producto resulta poco competitivo por comparaci髇 con importaciones m醩 baratas. Seg鷑 Kaplan y Laing (2005), es posible que la producci髇 local de medicamentos a un costo m醩 elevado que el de las importaciones equivalentes no tenga ninguna repercusi髇 sobre el acceso de los pacientes a los medicamentos que necesitan.
En el diagrama del marco representado en el gr醘ico 4.5 se describen los factores principales tanto desde la perspectiva de las pol韙icas industriales (recuadro A) como de las pol韙icas de salud p鷅lica (recuadro B). Como puede apreciarse, ambas perspectivas tienen objetivos comunes o compartidos, de modo que los objetivos de las pol韙icas industriales tambi閚 pueden contribuir a que se cumplan los de las pol韙icas de salud p鷅lica (recuadro C). La funci髇 del gobierno es proporcionar una gama de est韒ulos econ髆icos directos e indirectos y velar por que haya coherencia en todo el 醡bito de las pol韙icas (recuadro D).
Es importante que los incentivos para la producci髇 local no se dirijan 鷑icamente a aumentar el desarrollo industrial en s?mismo. Un buen ejemplo es la transferencia de tecnolog韆 de la OMS para vacunas y tecnolog韆s facilitadoras relacionadas con la gripe pand閙ica descrita en el recuadro 4.7. Tambi閚 deben dirigirse de forma expl韈ita a mejorar el acceso de la gente a los productos m閐icos de fabricaci髇 local; para lograrlo, es importante que los incentivos del gobierno se conciban para apoyar los objetivos comunes de las pol韙icas industriales y las de salud p鷅lica, por ejemplo, mediante el fortalecimiento de un organismo nacional de reglamentaci髇 eficaz. Las directrices de la OMS sobre transferencia de tecnolog韆 para la fabricaci髇 de productos farmac閡ticos ofrecen orientaci髇 鷗il en este campo.11
Actualmente, el per韔do transitorio estipulado en el Acuerdo sobre los ADPIC, durante el cual los pa韘es menos adelantados no est醤 obligados a conceder ni hacer respetar las patentes de productos farmac閡ticos hasta 2016, podr韆 ofrecer oportunidades para establecer la producci髇 local en esos pa韘es de los productos que a鷑 est醤 protegidos por patentes en otros pa韘es.12
Algunos proyectos actuales de transferencia de tecnolog韆 est醤 concebidos para que los pa韘es menos adelantados participen en iniciativas locales y regionales de fabricaci髇 mediante colaboraciones con empresas privadas y gobiernos. Una de estas iniciativas es la empresa mixta constituida por un fabricante indio de medicamentos gen閞icos y una empresa ugandesa, en cuyo marco los expertos de la India capacitan al personal local. Esta asociaci髇 dio lugar al establecimiento de una f醔rica cerca de Kampala para producir medicamentos antirretrov韗icos y antipal鷇icos; la OMS ha certificado que cumple con las buenas pr醕ticas de fabricaci髇 y ha precalificado dos de sus productos.
El Gobierno del Brasil colabora actualmente con el Ministerio de Salud de Mozambique para establecer en este pa韘 la primera f醔rica de producci髇 de antirretrov韗icos de primera l韓ea, sobre la base de la cartera de medicamentos elaborada por la Fundaci髇 Oswaldo Cruz. Como parte de un acuerdo firmado en 2011 para construir la f醔rica, el Brasil suministrar?equipo y capacitaci髇 para los t閏nicos locales que trabajar醤 en ella.
Recuadro 4.7. Transferencia de tecnolog韆 de la OMS para vacunas contra la gripe pand閙ica y tecnolog韆s facilitadoras conexas |
En el Plan de Acci髇 Mundial de la OMS contra la Gripe Pand閙ica, publicado en 2006, se se馻l?como prioridad la construcci髇 de plantas productoras de vacunas contra la gripe en los pa韘es en desarrollo para aumentar la capacidad y preparaci髇 frente a pandemias en el mundo.13 La OMS ha proporcionado financiaci髇 inicial a 14 fabricantes de vacunas en el Brasil, China, Egipto, la India, Indonesia, el Ir醤, Kazajst醤, la Rep鷅lica de Corea, M閤ico, Rumania, Serbia, Sud醘rica, Tailandia y Viet Nam para posibilitar la producci髇 nacional. |
Los m閠odos cl醩icos para la fabricaci髇 de vacunas antigripales como la t韕ica tecnolog韆 de cultivo del virus en huevos de gallina concebida en los a駉s cuarenta, que a鷑 supone la mayor parte de la producci髇 de estas vacunas, no est醤 protegidos por derechos de propiedad intelectual. En los Pa韘es Bajos se estableci?un centro de capacitaci髇 y transferencia de tecnolog韆 para concentrar los conocimientos te髍icos y pr醕ticos en un solo lugar desde el cual pueda transmitirse con eficacia la tecnolog韆 a muchos beneficiarios. En este centro se ha capacitado al personal de la mayor韆 de los pa韘es que aportaron fondos para el proyecto, as?como al personal de los organismos nacionales de reglamentaci髇 (Hendriks et al., 2011). |
Tecnolog韆s facilitadoras |
Tecnolog韆 de vacunas antigripales de virus vivos atenuados: Varios fabricantes optaron por utilizar esta tecnolog韆, que produce una vacuna de rendimiento elevado, barata y f醕il de administrar. A fin de facilitar el acceso a los conocimientos especializados, los datos cl韓icos y las cepas de siembra requeridas para esta tecnolog韆, la OMS, en nombre de los fabricantes de vacunas de los pa韘es en desarrollo, negoci?y adquiri?una licencia no exclusiva y transferible; se concedieron sublicencias a tres fabricantes en esos pa韘es. |
Tecnolog韆 de adyuvantes: Se ha demostrado que los adyuvantes permiten reducir la dosis de las vacunas contra la gripe pand閙ica y, por consiguiente, propician la vacunaci髇 de un mayor n鷐ero de personas. Sin embargo, los conocimientos especializados relacionados con estos adyuvantes han estado principalmente en manos de unos cuantos fabricantes multinacionales de vacunas. La OMS determin?que los derechos de propiedad intelectual de uno de los principales adyuvantes ten韆n un alcance geogr醘ico limitado y por lo tanto ese compuesto pod韆 producirse en los pa韘es en desarrollo. Con la finalidad de transmitir los conocimientos especializados necesarios para producir el adyuvante, la OMS facilit?el establecimiento de un centro de capacitaci髇 y transferencia de tecnolog韆 de adyuvantes en la Universidad de Lausana, que formul?los procesos de producci髇 correspondientes y ya ha transferido satisfactoriamente la tecnolog韆 a Indonesia y Viet Nam. |
En 2012 el Gobierno de Sud醘rica form? por medio de una empresa sudafricana, una sociedad mixta con una empresa suiza para establecer la primera planta en el pa韘 para la fabricaci髇 de principios activos de antirretrov韗icos, lo que supondr?la construcci髇 de una f醔rica para elaborar productos fluoroqu韒icos de mayor valor a partir de la fluorita extra韉a localmente. El objetivo del proyecto es reducir la dependencia de Sud醘rica de los medicamentos importados y posibilitar la fabricaci髇 de antirretrov韗icos a partir de principios activos obtenidos y producidos localmente.
7. Mecanismos de reglamentaci髇 y acceso a las tecnolog韆s m閐icas
La presente secci髇 se basa en la secci髇 A.6 del cap韙ulo II y se centra en el Programa de Precalificaci髇 de la OMS; la funci髇 de los donantes mundiales en la armonizaci髇 de las normas de reglamentaci髇; los sistemas complejos de suministro y de gesti髇; y el problema de los productos de calidad subest醤dar, espurios, de etiquetado enga駉so, falsificados o de imitaci髇.
La reglamentaci髇 de las tecnolog韆s m閐icas desempe馻 una funci髇 fundamental en la determinaci髇 del acceso a los productos m閐icos de calidad garantizada. Aunque en los 鷏timos a駉s ha habido avances favorables, el control de la reglamentaci髇 de los medicamentos y las tecnolog韆s m閐icas en los PBI y los PIM tienen que mejorarse a鷑 m醩. La OMS colabora con los Estados miembros en la evaluaci髇 de los sistemas nacionales de reglamentaci髇 para determinar las deficiencias, elaborar estrategias para introducir mejoras y prestarles apoyo a fin de que cumplan su compromiso de fortalecer la capacidad nacional en esta esfera. La OMS (2010c) ofrece un panorama de la situaci髇 en materia de reglamentaci髇 en 羏rica (v閍se el recuadro 4.8).
(a) El Programa de Precalificaci髇
Es una iniciativa de las Naciones Unidas administrada por la OMS que ha contribuido en gran medida a mejorar el acceso a los medicamentos de calidad en los pa韘es en desarrollo al velar por el cumplimiento de las normas de calidad (v閍se el recuadro 4.8). Su objetivo es facilitar el acceso a las tecnolog韆s m閐icas que cumplen con las normas internacionales de calidad, seguridad y eficacia; abarca los medicamentos para tratar la infecci髇 por el VIH/sida, la tuberculosis y el paludismo, los relativos a la salud reproductiva y la gripe, as?como las vacunas y los medios de diagn髎ticos.14
Recuadro 4.8. La OMS eval鷄 los sistemas de reglamentaci髇 farmac閡tica en los pa韘es del 羏rica subsahariana |
En un informe reciente, la OMS resume los resultados de las evaluaciones de los organismos nacionales de reglamentaci髇 farmac閡tica de 26 pa韘es africanos realizadas en un per韔do de ocho a駉s, y ofrece un panorama de la situaci髇 correspondiente en 羏rica (OMS, 2010c). |
El informe permiti?concluir que aun cuando hay estructuras para la reglamentaci髇 farmac閡tica y las principales funciones de reglamentaci髇 se abordan, en la pr醕tica, las medidas suelen ser insuficientes. Las deficiencias m醩 comunes son las leyes fragmentadas que deben unificarse, estructuras y procesos de gesti髇 poco eficaces, y una carencia grave de personal y recursos. En general, los pa韘es no disponen de la capacidad para controlar la calidad, seguridad y eficacia de los medicamentos que circulan en su mercado o pasan por su territorio. |
La OMS recomienda fortalecer la capacidad en materia de reglamentaci髇 en los pa韘es africanos mediante las estrategias siguientes: |
|
|
|
|
El Programa de Precalificaci髇 no reemplaza a los organismos nacionales de reglamentaci髇 ni a los sistemas nacionales de autorizaci髇 para la importaci髇 de tecnolog韆s m閐icas. Si un producto cumple los requisitos previstos y el lugar de fabricaci髇 cumple con las buenas pr醕ticas de fabricaci髇 vigentes, tanto el producto vinculado a un lugar de fabricaci髇 concreto como la informaci髇 sobre el fabricante se agregan a la lista de medicamentos precalificados que la OMS pone a disposici髇 en un sitio Web de acceso p鷅lico.15
La precalificaci髇 de la OMS es una norma de calidad reconocida que muchos donantes internacionales y organismos de adquisici髇 utilizan y toman como referencia.
(b) La reglamentaci髇 de los dispositivos m閐icos
Los dispositivos m閐icos constituyen una gama amplia de instrumentos, desde el simple depresor lingual de madera y el estetoscopio hasta los implantes y equipos de imaginolog韆 m閐ica m醩 sofisticados. Al igual que en el caso de las vacunas y los medicamentos, los gobiernos tienen que establecer pol韙icas que faciliten el acceso a dispositivos m閐icos de calidad y asequibles, as?como velar por su utilizaci髇 y eliminaci髇 seguras y adecuadas. Por consiguiente, se precisan sistemas de reglamentaci髇 s髄idos que velen por la seguridad, la eficacia y el desempe駉 de los dispositivos m閐icos. Un ejemplo reciente de esta necesidad son los implantes de mama fabricados con silicona de grado no m閐ico por una empresa con sede en Francia (v閍se el recuadro 4.9). En general, los dispositivos m閐icos son sometidos a controles reglamentarios, por lo que casi todos los pa韘es tienen una autoridad responsable de ejecutar y hacer cumplir la reglamentaci髇 sobre cada tipo de productos.16 Esto tambi閚 rige para los PBI y los PIM, donde hay m醩 de 70 organismos encargados del control reglamentario (OMS, 2010a); por el contrario, muchos otros pa韘es semejantes carecen de un organismo responsable de ejecutar y hacer cumplir la reglamentaci髇. La aplicaci髇 y el cumplimiento son complicados debido a la escasez de ingenieros biom閐icos profesionales, la falta de armonizaci髇 de las t閏nicas para la utilizaci髇 de los dispositivos m閐icos y la informaci髇 escasa. En la mayor韆 de los pa韘es no se emplean directrices, pol韙icas ni recomendaciones nacionales en materia de adquisici髇 de dispositivos m閐icos, ya sea porque no las hay o porque no se cuenta con una autoridad reconocida que las ponga en pr醕tica. Esto genera dificultades para establecer prioridades en la selecci髇 de estos dispositivos con base en sus repercusiones sobre la carga de morbilidad. La falta de organismos de reglamentaci髇, de normas y de aplicaci髇 de la reglamentaci髇 vigente repercute de manera negativa en el acceso a los productos de calidad. La OMS ha publicado un panorama mundial y principios rectores de la reglamentaci髇 de los dispositivos m閐icos para ayudar a los pa韘es a establecer sistemas adecuados en esta esfera (OMS, 2003a).
Recuadro 4.9. Europa refuerza los controles para garantizar la seguridad de los dispositivos m閐icos |
El marco jur韉ico de la Uni髇 Europea relacionado con la seguridad y el desempe駉 de los dispositivos m閐icos se armoniz?en los a駉s noventa.17 De conformidad con esta legislaci髇, antes de la comercializaci髇 los dispositivos m閐icos se someten a controles rigurosos realizados por organismos de evaluaci髇 independientes (organismos notificados), que examinan los datos del fabricante relativos al dise駉 y a la seguridad del producto. Pese a tales mecanismos de control, una empresa con sede en Francia utiliz?silicona de grado no m閐ico para fabricar implantes de mama, lo que result?en un porcentaje de roturas inusualmente elevado a corto plazo. Los incidentes de este tipo destacan la necesidad de modernizar y fortalecer la legislaci髇 de la Uni髇 Europea que se aplica a los dispositivos m閐icos. En febrero de 2012 el Comisario Europeo de Salud y Pol韙ica de Consumidores anunci?la culminaci髇 inminente de la revisi髇 de la legislaci髇 pertinente, fundamentada en el reconocimiento de las deficiencias de las leyes actuales. El Comisario tambi閚 pidi?a los Estados miembros que ejecutaran controles m醩 rigurosos y aumentaran la vigilancia de inmediato (European Commission, 2012). |
(c) La funci髇 de los donantes mundiales en la armonizaci髇 de las normas reglamentarias
Cada vez m醩, los donantes y programas de donaci髇 principales como el Fondo Mundial, el PEPFAR y el UNITAID financian programas importantes de adquisici髇 para aumentar el acceso a los medicamentos, con atenci髇 particular a la infecci髇 por el VIH/sida, la tuberculosis y el paludismo, importantes enfermedades infecciosas. Los donantes exigen el cumplimiento de determinadas normas de calidad y suelen tomar como referencia el Programa de Precalificaci髇 y las normas de calidad de la OMS. Las comunidades de donantes y las ONG recurren a los laboratorios de control de calidad precalificados por la OMS, cada vez m醩 accesibles en todas las regiones de esta organizaci髇, para los an醠isis pertinentes. Los donantes tambi閚 han comenzado a asignar fondos para que se establezcan sistemas nacionales de garant韆 de la calidad, y varios han financiado el fortalecimiento de la capacidad en materia de reglamentaci髇 en los pa韘es beneficiarios. Aunque se han realizado progresos notables, las pol韙icas de garant韆 de la calidad del Fondo Mundial, el PEPFAR, el UNITAID, el UNFPA, el Servicio Farmac閡tico Mundial y el UNICEF a鷑 no est醤 completamente armonizadas. Habida cuenta del alcance de estos programas y de la funci髇 preponderante que desempe馻n en la adquisici髇 de medicamentos para la infecci髇 por el VIH/sida, el paludismo y la tuberculosis, las divergencias en los requisitos de calidad y seguridad pueden causar distorsiones del mercado, ya que es necesario cumplir condiciones diferentes para los distintos compradores. La creaci髇 de un mercado competitivo 鷑ico ser韆 una contribuci髇 importante para posibilitar el acceso a medicamentos de buena calidad y asequibles.
(d) Sistemas de suministro y gesti髇 complejos
Uno de los principales determinantes de la reglamentaci髇 que tambi閚 se vinculan al comercio internacional es la fragmentaci髇 cada vez mayor de las cadenas de suministro mundiales. A fin de disminuir los costos, muchos fabricantes optaron en el pasado por externalizar la investigaci髇 b醩ica y la producci髇 de los principios activos y los componentes de los dispositivos m閐icos, por ejemplo, a pa韘es como China, la India y la Rep鷅lica de Corea. En consecuencia, el comercio creciente de los productos entre los continentes genera una cadena de suministro m醩 compleja, lo que representa un problema para los organismos de reglamentaci髇 que tienen que inspeccionar toda la cadena para velar por que los productos finales cumplan las normas de calidad exigidas.
Las formas farmac閡ticas o los dispositivos m閐icos acabados pueden haberse elaborado o ensamblado con materiales procedentes o externalizados de muchas partes del mundo. En el caso de los Estados Unidos, por ejemplo, el 80% de los principios activos y el 40% de los productos farmac閡ticos acabados se importan (Institute of Medicine, 2012).
Uno de los riesgos de comprar principios activos para medicamentos o partes para un dispositivo m閐ico en el extranjero es que resulta m醩 dif韈il inspeccionar los diversos elementos de la larga y compleja cadena de suministro. Por ejemplo, una empresa que ha recibido de un organismo de reglamentaci髇 estricto la certificaci髇 de buenas pr醕ticas de fabricaci髇 para suministrar principios activos tambi閚 puede comprarlos a otros fabricantes que no han sido certificados. Adem醩, el gran n鷐ero de interesados que pueden llegar a intervenir en la producci髇 de los principios activos puede ocasionar que los lugares de fabricaci髇 cambien, lo que genera riesgos que afectan al proceso y problemas relacionados con la transferencia de m閠odos.
(e) Los productos m閐icos de calidad subest醤dar, espurios, de etiquetado enga駉so, falsificados o de imitaci髇: una preocupaci髇 mundial
El aumento continuo de la producci髇, venta y utilizaci髇 de productos m閐icos de calidad subest醤dar, espurios, de etiquetado enga駉so, falsificados o de imitaci髇 (CSEEEFI) plantea problemas graves de salud p鷅lica. Los productos m閐icos que no cumplen las normas de calidad y contienen dosis incorrectas o nulas de principios activos o sustancias diferentes provocan fracasos terap閡ticos, agravamiento de las enfermedades, resistencia a los antibi髏icos e incluso la muerte. Aunque el n鷐ero de casos notificados de productos m閐icos CSEEEFI sigue en aumento, se desconoce la magnitud exacta del problema, ya que la diversidad de las fuentes de informaci髇 dificulta la compilaci髇 de los datos estad韘ticos.18
(i) 緿e qu?estamos hablando?
En tanto que los t閞minos "espurios, de etiquetado enga駉so, falsificados y de imitaci髇" se emplean en los debates de salud p鷅lica para describir el mismo problema de los medicamentos etiquetados incorrectamente de forma deliberada en lo que respecta a su identidad o procedencia, los medicamentos de calidad subest醤dar son aquellos que no cumplen las normas de calidad exigidas. En el recuadro 4.10 se resumen brevemente los principales t閞minos utilizados para describir los productos m閐icos de calidad subest醤dar y de imitaci髇. Si bien ambos fen髆enos representan una amenaza para la salud p鷅lica, es importante distinguirlos porque se requieren medidas y agentes diferentes para combatirlos de forma eficaz.
(ii) 緾u醠 es el problema?
Todos los medicamentos, sean originarios o gen閞icos, pueden ser falsificados: desde los f醨macos para el tratamiento de enfermedades potencialmente mortales hasta los analg閟icos y antihistam韓icos gen閞icos baratos.
Recuadro 4.10. Terminolog韆 de los medicamentos de calidad subest醤dar y de imitaci髇 |
En el debate de los medicamentos de calidad subest醤dar y de imitaci髇 se han empleado un sinn鷐ero de t閞minos y a veces se han dado significados diferentes a un mismo t閞mino. La manera en que estos t閞minos se utilizan y definen reviste particular importancia para la adopci髇 o aplicaci髇 de medidas razonables y aceptables para combatir la proliferaci髇 de medicamentos de calidad subest醤dar y de imitaci髇 (Clift, 2010). En 2010, la OMS llev?a cabo una encuesta en 60 Estados miembros para obtener informaci髇 sobre los diversos t閞minos y definiciones empleados en las legislaciones nacionales respectivas. Los resultados indicaron que la definici髇 legal del t閞mino "falsificado"19 var韆 en gran medida en los diversos pa韘es. |
Los medicamentos de calidad subest醤dar son productos farmac閡ticos que no cumplen las normas de calidad o las especificaciones, o ninguna de las dos. Cada producto farmac閡tico que un fabricante produce tiene que cumplir con normas de calidad y especificaciones al salir a la venta y durante su tiempo de conservaci髇, de conformidad con las prescripciones relativas al territorio de uso. Normalmente, el organismo nacional o regional de reglamentaci髇 farmac閡tica pertinente examina, eval鷄 y aprueba estas normas y especificaciones antes de que se autorice la venta del producto.20 |
Los productos m閐icos CSEEEFI son etiquetados incorrectamente de manera deliberada y fraudulenta en lo que respecta a su identidad u origen; por consiguiente, normalmente se desconoce su origen y su contenido no es fiable. Pueden incluir componentes correctos o incorrectos, carecer de principios activos, con tener una cantidad insuficiente o excesiva de principios activos, o presentarse en envases falsificados.21 |
En el Acuerdo sobre los ADPIC, el t閞mino "falsificado" se define en relaci髇 con las marcas de f醔rica de forma general, no espec韋icamente para el sector de la salud p鷅lica. Seg鷑 la nota a pie de p醙ina 14 a) del art韈ulo 51 de ese acuerdo: "se entender?por 'mercanc韆s de marca de f醔rica o de comercio falsificadas' cualesquiera mercanc韆s, incluido su embalaje, que lleven puesta sin autorizaci髇 una marca de f醔rica o de comercio id閚tica a la marca v醠idamente registrada para tales mercanc韆s, o que no pueda distinguirse en sus aspectos esenciales de esa marca, y que de ese modo lesione los derechos que al titular de la marca de que se trate otorga la legislaci髇 del pa韘 de importaci髇". As?pues, la falsificaci髇 se limita a las mercanc韆s que utilizan marcas de f醔rica id閚ticas o similares sin la autorizaci髇 del titular correspondiente; por lo general, supone la reproducci髇 servil de la marca de f醔rica protegida. Habida cuenta de la confusi髇 intencionada entre el producto aut閚tico y la copia, generalmente hay fraude; no obstante, en la pr醕tica la utilizaci髇 del t閞mino "falsificado" parece haberse desviado de esta acepci髇 limitada en varios documentos de la OMC, en los que abarca otras formas y categor韆s de violaci髇 de los derechos de propiedad intelectual. |
Pueden contener desde mezclas aleatorias de sustancias t髕icas peligrosas hasta sustancias inactivas e ineficaces. Algunos contienen un principio activo declarado y su aspecto es tan similar al producto genuino que logran enga馻r a los profesionales sanitarios y a los pacientes. Los productos m閐icos CSEEEFI siempre son ilegales.22
La naturaleza del problema de los productos m閐icos CSEEEFI es diferente en los distintos entornos. En algunos pa韘es, sobre todo en los desarrollados, las hormonas, los esteroides, los anticancerosos y los medicamentos de calidad de vida caros representan la mayor parte de los productos vendidos, a menudo mediante operaciones efectuadas en Internet. En otros pa韘es, estos productos suelen usurpar el lugar de medicamentos baratos, incluso gen閞icos.
En los pa韘es en desarrollo, la tendencia m醩 inquietante es la frecuencia de los productos m閐icos CSEEEFI para el tratamiento de enfermedades potencialmente mortales como el paludismo, la tuberculosis y la infecci髇 por el VIH/sida (v閍se el recuadro 4.11 sobre la calidad de los medicamentos antipal鷇icos en los pa韘es del 羏rica subsahariana). La experiencia ha demostrado que los grupos de pacientes vulnerables que pagan los medicamentos con sus propios medios suelen ser los m醩 afectados por las repercusiones negativas de los productos m閐icos CSEEEFI (OMS, 2011h).
Estos productos se encuentran en todas partes del mundo, pero generalmente son un problema mucho m醩 grave en las regiones donde los sistemas de reglamentaci髇 y cumplimiento de las leyes para el control de los medicamentos son m醩 deficientes. En los pa韘es industrializados con sistemas de reglamentaci髇 eficaces y control del mercado, la frecuencia de estos medicamentos es muy baja: menos del 1% del valor comercial, seg鷑 c醠culos de los pa韘es interesados.23
La principal motivaci髇 para producir y distribuir productos m閐icos CSEEEFI es la posibilidad de obtener ganancias enormes. Varios factores favorecen su producci髇 y distribuci髇, a saber:
- la falta de acceso equitativo y asequible a los medicamentos esenciales;
- la existencia de puntos de venta de medicamentos sin reglamentar;
- la falta de legislaci髇 adecuada;
- la ausencia o ineficacia de los organismos nacionales de reglamentaci髇 farmac閡tica;
- la aplicaci髇 inadecuada de la legislaci髇 vigente;
- las cadenas de suministro complejas; y
- la debilidad de las sanciones penales (OMS, 2011h).
緾髆o luchar contra los productos m閐icos CSEEEFI?
Combatir estos productos forma parte de la labor de los organismos de reglamentaci髇, pero otros organismos de aplicaci髇 de la ley tambi閚 intervienen en esta esfera (v閍se el apartado f) de la secci髇 B.1 del cap韙ulo II). En la mayor韆 de los pa韘es, los organismos de reglamentaci髇 pueden aplicar medidas contra estos productos y sus fabricantes. En el caso de los medicamentos de calidad subest醤dar, la identidad del productor es conocida y el problema reside en el incumplimiento de las buenas pr醕ticas de fabricaci髇. Por otra parte, los falsificadores suelen trabajar en sitios no autorizados con la intenci髇 de ocultar su identidad, lo que significa que la eficacia de las medidas de observancia adoptadas por las autoridades competentes solo puede ser parcial. As?pues, el enfoque normativo habitual adoptado respecto de los medicamentos fabricados l韈itamente pero de calidad subest醤dar no puede ser eficaz por s?solo. Para luchar eficazmente contra los productos m閐icos EEEFI es necesario que otras medidas, como los controles fronterizos y el enjuiciamiento penal, desempe馿n una funci髇 m醩 importante; adem醩, tienen que adaptarse a la situaci髇 de cada pa韘. Los controles fronterizos pueden ser eficaces en el caso de los productos importados y tienen particular importancia porque cada vez son m醩 los productos m閐icos CSEEEFI que se importan. En los pa韘es donde se fabrican estos productos es necesario hacer hincapi?en la localizaci髇 y el enjuiciamiento de los fabricantes locales. Se precisa, por consiguiente, la colaboraci髇 nacional e internacional con otras instituciones gubernamentales, incluidos los 髍ganos legislativos, los organismos responsables de hacer cumplir la ley y los tribunales (OMS, 2011h).
Recuadro 4.11. Estudio de la OMS sobre la calidad de algunos antipal鷇icos en seis pa韘es del 羏rica subsahariana |
La OMS hab韆 prestado apoyo anteriormente a los seis pa韘es que participaron en este estudio (el Camer鷑, Etiop韆, Ghana, Kenya, Nigeria y Tanzan韆) mediante medidas concretas concebidas para fortalecer el control reglamentario de los productos antipal鷇icos. De las 267 muestras sometidas a todas las pruebas necesarias, el 28,5% no cumpl韆n con las especificaciones, lo que representa una tasa de no conformidad elevada e indica un problema en la calidad de los antipal鷇icos que se distribuyen. La complejidad de los mercados y el n鷐ero de productos de los distintos fabricantes presentes en esos mercados parecen ser uno de los factores que dificultan la reglamentaci髇 farmac閡tica y aumentan la posibilidad de que los consumidores tengan acceso a medicamentos de calidad subest醤dar que circulan en el mercado. |
Al compararse las tasas de no conformidad de los productos importados y de los de fabricaci髇 local, se determin?que las m醩 elevadas correspond韆n a estos 鷏timos. Esto puede deberse a que las normas reglamentarias para los medicamentos de fabricaci髇 local y los importados son diferentes. La tasa total de no conformidad de las muestras de medicamentos precalificados por la OMS recogidas en los seis pa韘es que participaron en el estudio fue muy baja (menor del 4%), lo que destaca la importancia de la funci髇 normativa de esa Organizaci髇 en la reglamentaci髇 farmac閡tica y de su mecanismo de precalificaci髇 en la garant韆 de la calidad de los medicamentos adquiridos (OMS, 2011b). |
A escala internacional, el problema de los medicamentos espurios, de etiquetado enga駉so, falsificados o de imitaci髇 se abord?por primera vez en 1985, en la Conferencia de Expertos sobre Uso Racional de los Medicamentos celebrada en Nairobi. En esa reuni髇 se recomend?que la OMS, junto con otras organizaciones internacionales y ONG, estudiaran la factibilidad de establecer un centro de intercambio de informaci髇 para recoger datos e informar a los gobiernos sobre la naturaleza y magnitud de las falsificaciones. En 1988, los Estados miembros pidieron a la OMS que emprendiera programas para prevenir y detectar la exportaci髇, la importaci髇 y el contrabando de preparaciones farmac閡ticas de este tipo.24 La difusi髇 r醦ida de los productos m閐icos es EEEFI en muchos canales de distribuci髇, junto con el comercio y las ventas en aumento por Internet, llev? a que en 2006 finalmente se estableciera el Grupo Especial Internacional contra la Falsificaci髇 de Productos M閐icos (IMPACT, por la sigla en ingl閟), a fin de concientizar, intercambiar informaci髇, fomentar la cooperaci髇 y prestar ayuda en cuestiones relacionas con la falsificaci髇 de los medicamentos. El IMPACT, que cont?con la participaci髇 de organizaciones internacionales, ONG, organismos responsables de hacer cumplir la ley, organismos de reglamentaci髇 farmac閡tica y fabricantes de productos farmac閡ticos, elabor?el proyecto de principios y elementos para las legislaciones nacionales de lucha contra la falsificaci髇 de productos m閐icos, el cual se perfeccion?a鷑 m醩 en 2007 para abordar los problemas relativos a las definiciones, las responsabilidades de las partes interesadas de los sectores p鷅lico y privado, y las sanciones.25
La retenci髇 de medicamentos gen閞icos en tr醤sito por las autoridades aduaneras europeas (v閍se la secci髇 C m醩 adelante en el presente cap韙ulo) y las cr韙icas relativas a la relaci髇 de la industria farmac閡tica y otras partes interesadas, como la INTERPOL con el IMPACT desencadenaron un intenso debate. El tema central de este fue la relaci髇 entre la lucha contra los productos m閐icos CSEEEFI desde la perspectiva de la salud p鷅lica, la observancia de los derechos de propiedad intelectual y la funci髇 que la OMS debe o no desempe馻r, incluida su funci髇 en el IMPACT. Para responder a las preocupaciones planteadas, la Asamblea Mundial de la Salud convoc?en 2010 un grupo de trabajo integrado por representantes de los Estados miembros al que se encarg? entre otras cosas, que examinara la funci髇 de la OMS de velar por la disponibilidad de medicamentos de buena calidad, seguros, eficaces y asequibles, as?como la relaci髇 con el IMPACT y su funci髇 en la prevenci髇 y el control de los productos m閐icos CSEEEFI. El mandato estipulaba que estas cuestiones deb韆n examinarse desde la perspectiva de la salud p鷅lica, excluy閚dose de forma expl韈ita las consideraciones relativas al comercio y a los derechos de propiedad intelectual.26 En mayo de 2012, la Asamblea Mundial de la Salud estableci?otro mecanismo voluntario impulsado por los Estados miembros y encaminado a prevenir y controlar los productos m閐icos CSEEEFI y las actividades conexas desde la perspectiva de la salud p鷅lica, excluidas las consideraciones relativas al comercio y a los derechos de propiedad intelectual.27 El mecanismo presentar?informes peri骴icos a la Asamblea Mundial de la Salud sobre sus progresos y las recomendaciones derivadas de su trabajo.
(f) Otros determinantes de la reglamentaci髇 que afectan al acceso
Adem醩 de la fragmentaci髇 de la cadena de suministro y la globalizaci髇 de los procesos de fabricaci髇 de los productos farmac閡ticos y los productos m閐icos CSEEEFI, hay muchos otros problemas que afectan el funcionamiento de los sistemas de reglamentaci髇, a saber:
- la falta de apoyo pol韙ico unido a la escasez de recursos humanos y financieros de los organismos de reglamentaci髇;
- la falta de colaboraci髇 eficaz y de confianza en las decisiones de otros organismos de reglamentaci髇, en particular la tendencia a la duplicaci髇 de las inspecciones de los establecimientos de producci髇 y de las evaluaciones, lo que limita el valor a馻dido;
- la atenci髇 centrada en reglamentar los productos sin una supervisi髇 eficaz de la cadena de suministro;
- el escaso desarrollo de los sistemas para vigilar la seguridad de los productos una vez autorizada su venta; y
- la dualidad de criterios seg鷑 la cual, por ejemplo, no se exige que los productos de fabricaci髇 local cumplan con las mismas normas que los productos importados (v閍se el recuadro 4.11).
1. Para un panorama general de las pol韙icas de fijaci髇 de precios, v閍se: OCDE (2008). volver al texto
2. Puede consultarse informaci髇 sobre el sistema de Clasificaci髇 Anat髆ica, Terap閡tica y Qu韒ica en: ww.whocc.no/atc_ddd_index. volver al texto
3. V閍se http://whocc.goeg.at/Glossary/About. volver al texto
4. Puede consultarse una definici髇 en: www.eunethta.eu. volver al texto
5. V閍se www.ft.com/intl/cms/s/0/f0b1e114-e770-11e0-9da3?0144feab49a.html#axzz1c404Fdtv volver al texto
6. Fuentes: http://apps.who.int/medicinedocs/documents/ s19111es/s19111es.pdf; http://apps.who.int/medicinedocs/ documents/s19110es/s19110es.pdf; y http://apps.who. int/medicinedocs/en/m/abstract/Js19110es/. volver al texto
7. La versi髇 revisada de 2003 puede consultarse en: http://siteresources.worldbank.org/PROCUREMENT/Resources/ health-ev4.pdf. volver al texto
8. Puede consultarse en: www.who.int/hiv/amds/en/decisionmakersguide_ cover.pdf. volver al texto
9. Para obtener m醩 informaci髇, v閍se: www.who.int/phi/access_ medicines_feb2011/en/index.html; www.wipo.int//meetings/ en/2011/who_wipo_wto_ip_med_ge_11/; y www.wto. org/english/tratop_e/trips_e/techsymp_feb11_e/techsymp_ feb11_e.htm. volver al texto
10. Para un examen de las iniciativas que apoyan la inversi髇 en la producci髇 local y la transferencia de tecnolog韆 en relaci髇 con los productos farmac閡ticos, v閍se: OMS (2011e). volver al texto
11. V閍se www.who.int/medicines/areas/quality_safety/quality_ assurance/production/en/index.html. volver al texto
12. V閍nse los apartados g) y v) de la secci髇 B.1 del cap韙ulo II. volver al texto
13. V閍se http://whqlibdoc.who.int/hq/2006/WHO_IVB_06.13_ eng.pdf. volver al texto
14. V閍se http://apps.who.int/prequal/. volver al texto
15. V閍se http://apps.who.int/prequal/query/productregistry. aspx?list=in. volver al texto
16. V閍se www.who.int/medical_devices/policies/en/. volver al texto
17. V閍nse las directivas 90/385/EEC, 93/42/EEC y 98/79/EC, que pueden consultarse en: http://ec.europa.eu/health/ medical-devices/regulatory-framework/index_en.htm. volver al texto
18. V閍se www.who.int/medicines/services/counterfeit/en/. volver al texto
19. V閍se www.who.int/medicines/services/counterfeit/WHO_ ACM_Report.pdf. volver al texto
20. V閍se www.who.int/medicines/services/expertcommittees/pharmprep/43rdpharmprep/en/index.html. volver al texto
21. V閍se www.who.int/mediacentre/factsheets/fs275/en/. volver al texto
22. Ibid. volver al texto
23. Ibid. volver al texto
24. Asamblea Mundial de la Salud, resoluci髇 WHA 41.16: Uso racional de los medicamentos. volver al texto
25. V閍se www.who.int/impact/en/. volver al texto
26. Asamblea Mundial de la Salud, decisi髇 WHA63(10): Productos m閐icos de calidad subest醤dar, espurios, de etiquetado enga駉so, falsificados o de imitaci髇. Los documentos del Grupo de Trabajo y del nuevo Mecanismo de Estados miembros pueden consultarse en: http://apps.who.int/gb/ssffc/. volver al texto
27. Asamblea Mundial de la Salud, resoluci髇 WHA65.19: Productos m閐icos de calidad subest醤dar, espurios, de etiquetado enga駉so, falsificados o de imitaci髇. volver al texto